Сауда атауы: Семавик®
Халықаралық патенттелмеген атауы (ХПА): семаглутид
Дәрiлiк түрi: терi астына енгiзуге арналған ерiтiндi
Құрамы: 1 мл ерiтiндiнiң құрамында: белсендi ингредиент: семаглутид – 1,34 мг; қосалқы заттар: натрий гидрофосфаты дигидраты – 1,42 мг, пропиленгликоль – 14,0 мг, фенол – 5,5 мг, сұйылтылған хлорсутек қышқылы 10 % және/немесе натрий гидроксидi ерiтiндiсi 10 % – рН-ты 7,4-ке дейiн түзету үшiн, инъекцияға арналған су – 1 мл дейiн.
Сипаттамасы: Мөлдiр түссiз немесе түссiз дерлiк ерiтiндi.
Дәрiлiк препараттың фармакотерапиялық тобы: Гипогликемиялық зат — глюкагон тәрiздi пептид-1 (ГТП-1) аналогы.
АТХ коды: А10В106.
Фармакологиялық қасиеттерi
Семаглутид — химиялық синтез арқылы өндiрiлген ГТП-1 (ГТП-1Р) рецепторларының агонистi. Семаглутид — бұл адамның ГТП-1-мен 94 % гомологиялылығы бар ГТП-1 баламасы. Семаглутид ГТП-1Р агонистi ретiнде әрекет етедi, ол селективтi байланысып, ГТП-1Р белсендiредi. ГТП-1Р жергiлiктi ГТР-1 үшiн нысана болып қызмет етедi. ГТП-1 — глюкоза концентрациясын реттеуге және тәбетке, сондай-ақ жүрек-қан тамырлары жүйесiне (ЖҚТЖ) бiрден бiрнеше әсер ететiн физиологиялық гормон. Глюкоза концентрациясы мен тәбетке әсерi ұйқы безi мен мида орналасқан ГТП-1Р спецификалық бiлдiрiлген. Семаглутидтiң фармакологиялық концентрациясы төменде сипатталған әсерлердiң үйлесiмi арқылы қан глюкозасының концентрациясын және дене салмағын төмендетедi. ГТП-1Р сонымен қатар жүректiң, қан тамырларының, иммундық жүйенiң және бүйректiң белгiлi бiр аймақтарында ұсынылған, олардың белсендiрiлуi жүрек-қан тамырлары (ЖҚ) және микроциркуляторлық әсер етуi мүмкiн. Жергiлiктi ГТП-1-ден айырмашылығы, семаглутидтiң ұзартылған жартылай шығарылу кезеңi (шамамен 1 апта) оны аптасына 1 рет терi астына (т/а) қолдануға мүмкiндiк бередi. Альбуминмен байланысу семаглутидтiң ұзақ әсер етуiнiң негiзгi механизмi болып табылады, бұл оның бүйректермен шығарылуының төмендеуiне әкеледi және метаболикалық ыдыраудан қорғайды. Сонымен қатар, семаглутид дипептидилпептидаза-4 ферментiнiң ыдырауына қатысты тұрақты. Семаглутид глюкозаға тәуелдi инсулин секрециясын ынталандыру және глюкагон секрециясын тежеу арқылы қан глюкозасының концентрациясын төмендетедi. Осылайша, қан глюкозасының концентрациясы жоғарылаған кезде инсулин секрециясы ынталандырылады және глюкагон секрециясы тежеледi. Гликемия деңгейiн төмендету механизмi сонымен қатар тамақтан кейiнгi ерте кезеңде асқазанның босатылуының сәл кешiгуiн қамтиды. Гипогликемия кезiнде семаглутид инсулин секрециясын төмендетiп, глюкагон секрециясын төмендетпейдi. Семаглутид жалпы дене салмағын және майлы тiннiң массасын азайтады, энергия шығынын азайтады. Бұл механизм тәбеттiң жалпы төмендеуiне, соның iшiнде қанығу сигналдарының күшейтiлуiне және аштық сигналдарының әлсiреуiне, сондай-ақ тамақ қабылдауды бақылауды жақсартуға және тамаққа әуестiктiң төмендеуiне әсер етедi. Дене салмағын азайту арқылы инсулинге төзiмдiлiк те төмендейдi. Сонымен қатар, семаглутид құрамында май мөлшерi жоғары тағамды артық көрудi төмендетедi. Жануарларға жүргiзiлген зерттеулерде семаглутид мидың белгiлi бiр аймақтарына сiңiрiлетiнi және негiзгi қанығу сигналдарын күшейтетiнi және негiзгi аштық сигналдарын әлсiрететiнi көрсетiлген. Ми тiндерiнiң оқшауланған аймақтарына әсер ету арқылы семаглутид қанықтылық сезiмiмен байланысты нейрондарды белсендiредi және аштық сезiмiмен байланысты нейрондарды тежейдi. Клиникалық зерттеулерде (КЗ) семаглутид қан плазмасының липидтерiне оң әсер еттi, систолалық қан қысымын (ҚҚ) төмендетiп, қабынуды азайтты. Жануарларға жүргiзiлген зерттеулерде семаглутид атеросклероздың дамуын тежейдi, қолқа түйiншектерiнiң одан әрi дамуына жол бермейдi және түйiншектердегi қабынуды азайтады.
Фармакодинамика
Барлық фармакодинамикалық зерттеулер аптасына 1 рет 1 мг семаглутидтiң тепе-теңдiк шоғарлануында 12 апталық терапиядан кейiн (дозаны жоғарылату кезеңiн қоса) жүргiзiлдi.
Аш қарынға гликемия деңгейi және тамақтан кейiнгi гликемия деңгейi
Семаглутид аш қарынға глюкоза концентрациясын және тамақтан кейiнгi глюкоза концентрациясын төмендетедi. Плацебомен салыстырғанда 2-типтi қант диабетi (ҚД2) бар пациенттерге 1 мг семаглутидпен терапия келесi көрсеткiштерге қатысты бастапқы мәннен (ммоль/л) абсолюттi өзгерiс және плацебомен салыстырғанда салыстырмалы төмендеу тұрғысынан глюкоза концентрациясының төмендеуiне әкелдi (%): аш қарынға глюкоза концентрациясы (1,6 ммоль/л; 22 %); тамақтанғаннан кейiн 2 сағаттан кейiн глюкоза концентрациясы (4,1 ммоль/л; 37 %); глюкозаның орташа тәулiктiк концентрациясы (1,7 ммоль/л; 22 %) және 3 тамақтану үшiн глюкоза концентрациясының тамақтан кейiнгi шыңдары (0,6–1,1 ммоль/л). Семаглутид бiрiншi дозаны енгiзгеннен кейiн аш қарынға глюкоза концентрациясын төмендеттi.
Ұйқы безiнiң бета жасушаларының функциясы және инсулин секрециясы
Семаглутид аш қарынға глюкоза концентрациясын және тамақтан кейiнгi глюкоза концентрациясын төмендетедi. Плацебомен салыстырғанда 2-типтi қант диабетi (ҚД2) бар пациенттерге 1 мг семаглутидпен терапия келесi көрсеткiштерге қатысты бастапқы мәннен (ммоль/л) абсолюттi өзгерiс және плацебомен салыстырғанда салыстырмалы төмендеу тұрғысынан глюкоза концентрациясының төмендеуiне әкелдi (%): аш қарынға глюкоза концентрациясы (1,6 ммоль/л; 22 %); тамақтанғаннан кейiн 2 сағаттан кейiн глюкоза концентрациясы (4,1 ммоль/л; 37 %); глюкозаның орташа тәулiктiк концентрациясы (1,7 ммоль/л; 22 %) және 3 тамақтану үшiн глюкоза концентрациясының тамақтан кейiнгi шыңдары (0,6–1,1 ммоль/л). Семаглутид бiрiншi дозаны енгiзгеннен кейiн аш қарынға глюкоза концентрациясын төмендеттi.
Глюкагон секрециясы
Семаглутид аш қарынға глюкагон концентрациясын және тамақтан кейiнгi глюкагон концентрациясын төмендетедi. ҚД2 бар пациенттерде семаглутид плацебомен салыстырғанда глюкагон концентрациясының салыстырмалы төмендеуiне әкеледi: аш қарынға глюкагон концентрациясы (8–21 %), тамақтан кейiнгi глюкагон жауабы (14–15 %) және глюкагонның орташа тәулiктiк концентрациясы (12 %).
Глюкозаға тәуелдi инсулин секрециясы және глюкозаға тәуелдi глюкагон секрециясы
Семаглутид инсулин секрециясын ынталандыру және глюкозаға тәуелдi түрде глюкагон секрециясын төмендету арқылы қандағы глюкозаның жоғары концентрациясын төмендеттi. Семаглутидтi енгiзгеннен кейiн инсулин секрециясының ҚД2 бар пациенттерде жылдамдығы денi сау ерiктiлердегiмен салыстырылды. Индукцияланған гипогликемия кезiнде семаглутид плацебомен салыстырғанда глюкагон концентрациясының жоғарылауына қарсы реттеушi жауапты өзгертпедi, сонымен қатар ҚД2 бар пациенттерде С-пептид концентрациясының төмендеуiн күшейтпедi.
Асқазанның босатылуы
Семаглутид асқазанның тамақтан кейiнгi ерте босатылудың сәл кешiгуiн тудырды, осылайша тамақтан кейiнгi глюкозаның қанға түсу жылдамдығын төмендеткен.
Дене салмағы және дене құрамы
Зерттелген салыстыру препараттарымен (плацебо, ситаглиптин, босатылуы кешiктiрiлген эксенатид (БК), дулаглутид және гларгин инсулинi) салыстырғанда семаглутидтi қолдану кезiнде дене салмағының көбiрек төмендеуi байқалды («Клиникалық тиiмдiлiк және қауiпсiздiк» бөлiмiн қар.). Семаглутидтi қолдану кезiнде дене салмағының жоғалуы негiзiнен бұлшықет массасының жоғалуынан 3 есе артық майлы тiннiң жоғалуына байланысты болды.
Тәбет, калория тұтыну және азық-түлiк таңдау
Плацебомен салыстырғанда семаглутид ad libltum қатарынан үш рет тамақтану кезiнде калория мөлшерiн 18–35 %-ға азайтты. Бұған семаглутидпен ынталандырылған аш қарынға да, тамақтанғаннан кейiн де тәбеттiң тежелуi, тамақтануды бақылаудың жақсаруы, тамаққа (әсiресе майлылығы жоғары тамаққа) әуестiктiң әлсiреуi.
Аш қарынға липидтер және тамақтан кейiнгi липидтер
Плацебомен салыстырғанда семаглутид триглицеридтер мен холестерин концентрациясын өте төмен тығыздықты липопротеидтер (ӨТТЛП) аш қарынға сәйкесiнше 12 % және 21 % төмендеттi. Май мөлшерi жоғары тамақтануға жауап ретiнде триглицеридтер мен ӨТТЛП холестерин концентрациясының тамақтан кейiнгi жоғарылауы 40 %-дан астамға төмендедi.
Жүрек электрофизиологиясы (ЖЭФ)
Семаглутидтiң жүректегi реполяризация процесiне әсерi ЖЭФ зерттеуiнде сыналды. Семаглутидтi терапевтикалық дозадан асатын дозаларда қолдану (тепе-теңдiк концентрациясында 1,5 мг дейiн) түзетiлген QТ аралығының ұзаруына әкелмедi.
Фармакокинетикасы
Препарат аптасына 1 рет енгiзуге жарамды, өйткенi семаглутидтiң жартылай шығарылу кезеңi шамамен 1 аптаға тең.
Сiңiрiлуi
Плазмадағы максималды концентрациясына (Cmax) жету уақыты препараттың дозасын енгiзгеннен кейiн 1 күннен 3 күнге дейiн құрады. Препараттың тепе-теңдiк концентрациясына (AUCt/24) препаратты бiр реттiк апта сайынғы қолданғаннан кейiн 4–5 аптадан кейiн қол жеткiзiлдi. Семаглутидтi 0,5 мг және 1 мг дозада т/а енгiзгеннен кейiн, ҚД2 бар пациенттерде оның тепе-теңдiк концентрациясының орташа көрсеткiштерi сәйкесiнше шамамен 16 нмоль/л және 30 нмоль/л құрады. Семаглутидтiң 0,5 мг және 1 мг дозалары үшiн экспозиция енгiзiлген дозаға пропорционалды түрде артады. Семаглутидтi iштiң алдыңғы қабырғасына, жамбасқа немесе иыққа т/а енгiзген кезде ұқсас экспозицияға қол жеткiзiледi. Т/а енгiзуден кейiн семаглутидтiң абсолюттi биожетiмдiлiгi 89 % құрады.
Таралуы
ҚД2 бар пациенттерге т/а енгiзгеннен кейiн тiндердегi семаглутидтiң таралуының орташа көлемi шамамен 12,5 л құрады. Семаглутид айтарлықтай дәрежеде қан плазмасының альбуминiмен байланысты (>99 %).
Биотрансформациясы
Семаглутид ақуыздың пептидтiк негiзiнiң протеолитикалық ыдырауы және кейiннен бүйiрлiк тiзбектiң май қышқылының бета-тотығуы арқылы түрлендiрiледi.
Элиминациясы
Асқазан-iшек жолдары (АІЖ) және бүйрек семаглутид пен оның метаболиттерiн жоюдың негiзгi жолдары болып табылады. Енгiзiлген семаглутид дозасының 2/3 бөлiгi бүйрек арқылы, ал 1/3 бөлiгi iшек арқылы шығарылады. Енгiзiлген дозаның шамамен 3 %-ы бүйрек арқылы өзгермеген семаглутид түрiнде шығарылады. ҚД2 бар пациенттерде семаглутид клиренсi шамамен 0,05 л/сағ құрады. Элиминациялық жартылай шығарылу кезеңi шамамен 1 аптаға тең семаглутид препараттың соңғы дозасын енгiзгеннен кейiн шамамен 5 апта бойы жалпы қан ағымында болады.
Пациенттердiң ерекше топтары
Жасына, жынысына, нәсiлiне және этникалық тиесiлiлiгiне, дене салмағына, бүйрек немесе бауыр жеткiлiксiздiгiнiң болуына байланысты семаглутид дозасын түзету қажет емес.
Жасы
20 мен 86 жас аралығындағы пациенттердi қамтитын фазалар үшiн КЗ кезiнде алынған деректерге сүйене отырып, жас семаглутидтiң фармакокинетикасына әсер етпегенi көрсетiлген.
Жынысы
Жыныс семаглутидтiң фармакокинетикасына әсер еткен жоқ.
Нәсiлi
Нәсiлдiк топ (ақ, қара немесе афроамерикалық, азиялық) семаглутидтiң фармакокинетикасына әсер еткен жоқ.
Этникалық тиесiлiлiгi
Этникалық тиесiлiлiгi (латын америкалық) семаглутидтiң фармакокинетикасына әсер еткен жоқ.
Дене салмағы
Дене салмағы семаглутидтiң экспозициясына әсер еттi. Жоғары дене салмағы экспозицияның төмендеуiне әкеледi. Семаглутидтiң 0,5 мг және 1 мг-ға тең дозалары препараттың дене салмағының 40 кг-нан 198 кг-ға дейiнгi диапазонында жеткiлiктi экспозициясын қамтамасыз етедi.
Бүйрек жеткiлiксiздiгi
Бүйрек жеткiлiксiздiгi семаглутидтiң фармакокинетикасына клиникалық маңызды әсер еткен жоқ. Бұл семаглутидтiң 0,5 мг тең бiр реттiк дозасын зерттеуде бүйрек функциясы қалыпты пациенттермен салыстырғанда бүйрек жеткiлiксiздiгiнiң дәрежесi әртүрлi пациенттерде (жеңiл, орташа, ауыр немесе диализдегi пациенттерде) көрсетiлдi. Бұл сондай-ақ ҚД2 және бүйрек жеткiлiксiздiгi бар пациенттер үшiн За фазалық КЗ деректерi негiзiнде көрсетiлдi, дегенмен бүйрек ауруының соңғы сатысындағы пациенттерде қолдану тәжiрибесi шектеулi болды.
Бауыр жеткiлiксiздiгi
Бауыр жеткiлiксiздiгi семаглутидтiң экспозициясына әсер етпедi. Семаглутидтiң фармакокинетикалық қасиеттерi қалыпты бауыр функциясы бар пациенттермен салыстырғанда бауыр жеткiлiксiздiгiнiң әртүрлi дәрежесi (жеңiл, орташа, ауыр) бар пациенттерде семаглутидтiң бiр реттiк дозасын 0,5 мг-ға тең зерттеу барысында бағаланды.
Балалар мен жасөспiрiмдер
Балалар мен 18 жасқа дейiнгi жасөспiрiмдерде семаглутид зерттеулерi жүргiзiлген жоқ.
Қолдану көрсетiлiмдерi
Семавик® препараты гликемиялық бақылауды жақсарту үшiн диета мен жаттығулар аясында 2-типтi қант диабетi бар ересек пациенттерде мынадай түрiнде қолдануға арналған:
Семавик® препараты жүрек-қан тамырлары ауруларын стандартты емдеуге қосымша ретiнде 2-типтi қант диабетi және жоғары жүрек-қан тамырлары қаупi бар пациенттерге үлкен жүрек-қан тамырлары оқиғаларының* даму қаупiн азайту үшiн көрсетiлген (бiрiншi үлкен жүрек-қан тамырлары оқиғасының басталу уақытын талдау негiзiнде – «Фармакологиялық қасиеттер» бөлiмiн, «ЖҚТЖ-ға әсерiн бағалау» iшкi бөлiмiн қар.).
*үлкен жүрек-қан тамырлары оқиғаларына мыналар жатады: жүрек-қан тамырлары патологиясы салдарынан өлiм, өлiмге әкелмейтiн миокард инфарктiсi, өлiмге әкелмейтiн инсульт.
Қарсы көрсетiлiмдерi
Тиiмдiлiгi мен қауiпсiздiгi бойынша деректердiң болмауына немесе қолдану тәжiрибесiнiң шектелуiне байланысты Семавик® препаратын пациенттердiң келесi топтарында және мынадай жағдайларда/ауруларда қолдану қарсы көрсетiледi:
Сақтықпен
Семавик® препаратын бүйрек жеткiлiксiздiгi бар пациенттерде және анамнезiнде панкреатитi бар пациенттерде сақтықпен қолдану ұсынылады («Ерекше нұсқаулар» бөлiмiн қар.).
Жүктiлiк кезiнде және емiзу кезеңiнде қолданылуы
Жүктiлiк
Жануарларға жүргiзiлген зерттеулер препараттың репродуктивтi уыттылығын көрсеттi («Клиникаға дейiнгi қауiпсiздiк деректерi» бөлiмiн қар.). Жүктi әйелдерде семаглутидтi қолдану туралы деректер шектеулi. Жүктiлiк кезiнде семаглутидтi қолдануға болмайды. Бала көтеру потенциалы сақталған әйелдерге семаглутидпен терапия кезiнде контрацепцияны қолдану ұсынылады. Егер пациент әйел жүктiлiкке дайындалса немесе жүктi болса, семаглутидпен терапияны тоқтату керек. Ұзақ жартылай шығарылу кезеңiне байланысты семаглутидпен терапияны жоспарланған жүктiлiк басталғанға дейiн кемiнде 2 ай бұрын тоқтату керек («Фармакокинетика» бөлiмiн қар.).
Емiзу кезеңi
Емiзетiн егеуқұйрықтарда семаглутид сүтке енген. Емiзулi сәби үшiн қауiптi жоққа шығаруға болмайды. Емiзу кезiнде семаглутидтi қолдануға болмайды.
Қолдану тәсiлi және дозалар
Қолдану тәсiлi
Семавик® препараты тамақтануға қарамастан, аптасына 1 рет кез келген уақытта қолданылады. Семавик® препаратын iшке, жамбасқа немесе иыққа терi астына (т/а) енгiзедi. Инъекция орны дозаны түзетпестен өзгеруi мүмкiн. Семавик® препаратын көктамыр iшiне және бұлшықет iшiне енгiзуге болмайды. Қолдану әдiсi туралы ақпарат «Пайдалану жөнiндегi нұсқаулық» бөлiмiнде берiлген. Қажет болса, апта сайынғы енгiзу күнiн екi инъекция арасындағы уақыт аралығы кемiнде 3 күн (>72 сағат) болған жағдайда өзгертуге болады.
Дозалар
Семавик® препаратының бастапқы дозасы аптасына 1 рет 0,25 мг құрайды. 4 аптадан кейiн дозаны аптасына 1 рет 0,5 мг-ға дейiн арттыру керек. Гликемиялық бақылауды одан әрi жақсарту үшiн препаратты аптасына 1 рет 0,5 мг дозада қолданғаннан кейiн кем дегенде 4 аптадан кейiн дозаны аптасына 1 рет 1 мг-ға дейiн арттыруға болады. Семавик® 0,25 мг препаратының дозасы терапевтiк емес. Семавик® препаратын монотерапия түрiнде немесе бiр немесе одан да көп гипогликемиялық препараттармен бiрге қолдануға болады («Клиникалық тиiмдiлiк және қауiпсiздiк» бөлiмiн қар.). Семавик® препаратын метформинмен және/немесе тиазолидиндионмен алдыңғы терапияға қосқанда метформинмен және/немесе тиазолидиндионмен терапияны бұрынғы дозаларда жалғастыруға болады. Семавик® препаратын сульфонилнесепнәр туындыларымен немесе инсулинмен жүргiзiлетiн терапияға қосқанда гипогликемия қаупiн азайту мақсатында сульфонилнесепнәр немесе инсулин туындысының дозасын төмендету көзделуi тиiс («Ерекше нұсқаулар» бөлiмiн қар.). Семавик® препаратын қолдану қан глюкозасының концентрациясын өзiн-өзi бақылауды қажет етпейдi. Семавик® препаратын сульфонилнесепнәр туындысымен немесе инсулинмен бiрге қолданған кезде сульфонилнесепнәр немесе инсулин туындысының дозасын түзету үшiн қан глюкозасының концентрациясын осындай өзiн-өзi бақылау қажет болуы мүмкiн.
Өткiзiп алынған доза
Дозаны өткiзiп алған жағдайда Семавик® препаратын жоспарланған дозаны енгiзген сәттен бастап 5 күн iшiнде мүмкiндiгiнше тез енгiзу керек. Егер өткiзiп жiберу ұзақтығы 5 күннен асса, өткiзiп алған дозаны енгiзудiң қажетi жоқ. Семавик® препаратының келесi дозасын әдеттегi жоспарланған күнi енгiзу қажет. Әрбiр жағдайда пациенттер әдеттегi бiр реттiк апта сайынғы енгiзу кестесiн қайта бастай алады.
Препаратты пациенттердiң арнайы клиникалық топтарында қолдану
Балалар мен жасөспiрiмдер
Семавик® препаратын 18 жасқа дейiнгi балаларда қолдану тиiмдiлiк пен қауiпсiздiк жөнiндегi деректердiң болмауына байланысты қарсы көрсетiлген.
Егде жастағы пациенттер (≥ 65 жас)
Жасқа байланысты дозаны түзету қажет емес. 75 жастан асқан пациенттерде семаглутидтi қолдану тәжiрибесi шектеулi.
Бүйрек функциясы бұзылған пациенттер
Бүйрек жеткiлiксiздiгi бар пациенттерде дозаны түзету қажет емес. Бүйрек жеткiлiксiздiгiнiң соңғы сатысындағы пациенттерде Семавик® препаратын қолдану тәжiрибесi жоқ; мұндай пациенттерде Семавик® препаратын қолдану қарсы көрсетiлген.
Бауыр функциясы бұзылған пациенттер
Бауыр жеткiлiксiздiгi бар пациенттерде дозаны түзету қажет емес («Фармакокинетика» бөлiмiн қар.). Ауыр дәрежедегi бауыр жеткiлiксiздiгi бар пациенттерде семаглутидтi қолдану тәжiрибесi шектеулi; мұндай пациенттерде Семавик® препаратын қолдану қарсы көрсетiлген.
Жанама әсерi
Жүрек айнуы, диарея мен құсуды қоса алғанда, АІЖ тарапынан бұзылыстар КЗ кезiнде ең жиi хабарланған жағымсыз реакциялар (ЖР) болды. Жалпы алғанда, бұл реакциялардың ауырлық дәрежесi жеңiл немесе орташа және олар қысқа мерзiмдi болды. Семавик® препаратын қолдану кезiнде мүмкiн болатын жағымсыз реакциялар ДДҰ ұсынымдарына сәйкес олардың пайда болу жиiлiгiн көрсете отырып, MedDRA реттеу қызметiне арналған сөздiкке сәйкес жүйелiк-органдық кластарға бөлiнедi: өте жиi: (≥1/10), жиi (≥1/100, бiрақ <1/10), сирек (≥1/1000, бiрақ <1/100), сирек (≥1/10 000, бiрақ <1/1000), өте сирек (<1/10 000), жиiлiгi белгiсiз (қолда бар деректер негiзiнде бағалау мүмкiн емес). Әр топта ЖР даму жиiлiгi ауырлық дәрежесiн төмендету бойынша ұсынылған.
1-кесте. КЗ 3 фазасын жүргiзу кезiнде анықталған жағымсыз реакциялар
| MedDRA органдар жүйесi | Өте жиi | Жиi | Жиi емес | Сирек |
|---|---|---|---|---|
| Иммундық жүйе тарапынан бұзылыстар | Анафилактикалық реакциялар | |||
| Зат алмасы және тамақтану тарапынан бұзылыстар | Инсулинмен немесе сульфонилнесепнәр туындыларымен бiрге қолданғандағы гипогликемия⁽ᵃ⁾ | Басқа АГГП мен бiрге қолданғандағы гипогликемия⁽ᵃ⁾ тәбеттiң төмендеуi | ||
| Жүйке жүйесi тарапынан бұзылыстар | Бас айналу | Дизгевзия | ||
| Көру мүшесi тарапынан бұзушылықтар | Диабеттiк ретинопатияның асқынулары⁽ᵇ⁾ | |||
| Жүрек тарапынан бұзушылықтар | Жүрек соғу жиiлiгiнiң (ЖСЖ) жоғарылауы | |||
| АІЖ тарапынан бұзылыстар | Жүрек айнуы, диарея | Құсу, iштiң ауыруы, iштiң кебуi, iш қату, диспепсия, гастрит, гастроэзофагеальдi рефлюкс ауруы, кекiру, метеоризм | ||
| Бауыр мен өт жолдары тарапынан бұзылыстар | Холелитиаз | |||
| Енгiзу орнындағы жалпы бұзылулар мен бұзылыстар | Шаршағыштық | Енгiзу орнындағы реакциялар | ||
| Зертханалық және аспаптық деректер | Липаза белсендiлiгiнiң жоғарылауы, амилаза белсендiлiгiнiң жоғарылауы, дене салмағының төмендеуi |
⁽ᵃ⁾қан плазмасындағы глюкоза концентрациясы < 3,1 ммоль/л кезiндегi ауыр (басқа адамның көмегiн қажет ететiн) немесе симптоматикалық ретiнде анықталған гипогликемия
⁽ᵇ⁾диабеттiк ретинопатияның асқынулары мыналардың тiркесiмi болып табылады: көздiң торлы қабығының фотокоагуляциясы қажеттiлiгi, препараттарды интравитреальдi енгiзу қажеттiлiгi, шыны тәрiздi денеден қан кету, ҚМ-мен байланысты соқырлықтың дамуы
Жиiлiк ЖҚ нәтижелерiн зерттеуге негiзделген.
Жеке жағымсыз реакциялардың сипаттамасы
Гипогликемия
Семавик® препаратымен монотерапия кезiнде ауыр гипогликемия эпизодтары байқалмады. Ауыр дәрежелi гипогликемия негiзiнен Семавик® препаратын сульфонилнесепнәр туындысымен немесе инсулинмен бiрге қолданғанда байқалды. Сульфонилнесепнәр туындысын, АГГП қоспағанда, Семавик® препаратын басқалармен бiрге қолданғанда ауыр гипогликемияның бiрнеше эпизодтары байқалды.
Асқазан-iшек жолының тарапынан ЖР
Семавик® препаратымен 0,5 мг және 1 мг дозада терапия кезiнде пациенттерде жүрек айнуы, диарея және құсу байқалды. Реакциялардың көпшiлiгi жеңiлден орташа ауырлыққа дейiн және қысқа мерзiмдi болды. ЖР пациенттердiң тиiсiнше 3,9 % және 5,9 % КЗ-ден мерзiмiнен бұрын шығарылуына себеп болды. Көбiнесе ЖР туралы бұл терапияның алғашқы айларында хабарланған.
Диабеттiк ретинопатияның асқынулары
ҚД2 және жоғары ЖҚ қаупi бар, ҚД ұзақ ағымы және гликемияны жеткiлiксiз бақылауы бар пациенттер қатысқан 2 жас жалғасатын КЗ-де плацебо қабылдаған пациенттермен салыстырғанда (1,8 %) Семавик® препаратымен емделген пациенттердiң көбiрек санында диабеттiк ретинопатияның расталған асқыну жағдайлары (3,0 %) дамыды. КЗ басында анамнезiнде диабеттiк ретинопатия бар пациенттерде асқынулардың дамуының абсолюттi қаупiнiң жоғарылауы жоғарырақ болды. Диабеттiк ретинопатияның расталған анамнезi жоқ пациенттерде Семавик® және плацебо препараттарын қолданғанда оқиғалар саны бiрдей болды. 1 жылға дейiн жалғасқан КЗ-де диабеттiк ретинопатиямен байланысты ЖР жиiлiгi Семавик® препараты мен салыстыру препараттары тобында бiрдей болды.
ЖР себебiнен емдеудi тоқтату
ЖР себебiнен емдеудi тоқтату жиiлiгi Семавик® 1 мг препаратымен емделген пациенттер үшiн 8,7 % құрады. Емдеудi тоқтатуға әкелетiн ең көп таралған ЖР АІЖ тарапынан бұзылыстар болды.
Енгiзу орнындағы реакциялар
0,5 мг және 1 мг семаглутидтi қабылдаған пациенттердiң 0,6 % және 0,5 %-нде енгiзу орнындағы реакциялар (мысалы, енгiзу орнындағы бөртпе, қызару) туралы хабарланды. Бұл реакциялар әдетте жеңiл болды.
Иммуногендiлiгi
Ақуызды және пептидтi дәрiлiк препараттардың ықтимал иммуногендiк қасиеттерiне байланысты пациенттерде Семавик® препаратымен терапиядан кейiн семаглутидке антиденелер пайда болуы мүмкiн. КЗ соңында кез келген уақытта семаглутидке антиденелер анықталған пациенттердiң үлесi төмен болды (1–2 %) және ешбiр пациентте семаглутидке бейтараптандыратын антиденелер немесе эндогендi ГТП-1 бейтараптандыратын әсерi бар антиденелер табылған жоқ.
Егер нұсқаулықта көрсетiлген жағымсыз дәрiлiк реакциялардың кез келгенi нашарласа немесе нұсқаулықта көрсетiлмеген кез келген басқа жағымсыз дәрiлiк реакциялар пайда болса, бұл туралы дәрiгерге хабарлау қажет.
Артық дозалау
Симптомдары
КЗ барысында бiр реттiк дозада 4 мг-ға дейiн және аптасына 4 мг-ға дейiн артық дозалану туралы хабарланды. Хабарланған ең көп таралған ЖР жүрек айнуы болды. Барлық пациенттер асқынусыз жазылды.
Емдеу
Семавик® препаратының артық дозалануы кезiнде спецификалық антидот жоқ. Артық дозаланған жағдайда тиiстi симптоматикалық терапияны жүргiзу ұсынылады. Препараттың ұзақ шығарылу кезеңiн (шамамен 1 апта) ескере отырып, артық дозалану симптомдарын ұзақ бақылау және емдеу қажет болуы мүмкiн.
Басқа дәрiлiк заттармен өзара әрекеттесуi
Фармакодинамикалық өзара әрекеттесу
Семаглутидтi in vitro зерттеулерi цитохром Р450 (СУР) жүйесiнiң ферменттерiн тежеу немесе индукциялау және дәрiлiк препараттарды тасымалдаушыларды тежеу ықтималдығы өте аз екенiн көрсеттi. Семаглутидтi қолданған кезде асқазанның босатылуының кешiгуi iлеспе ауыз арқылы қабылданатын дәрiлiк препараттардың сiңiрiлуiне әсер етуi мүмкiн.
Семаглутидтi АІЖ тез сiңiрiлудi қажет ететiн ауызша дәрiлiк препараттарды қабылдайтын пациенттерде сақтықпен қолдану керек.
Парацетамол
Стандартталған тамақтану тестi кезiнде парацетамолдың фармакокинетикасын бағалау кезiнде семаглутид асқазанның босатылуын кешiктiретiнi анықталды. Бiр мезгiлде 1 мг AUC0-60 мин дозада семаглутидтi және парацетамолдың Cmax қолданғанда тиiсiнше 27 %-ке және 23 %-ке төмендедi. Бұл кезде парацетамолдың жалпы экспозициясы (AUC0-5 сағ) өзгерген жоқ. Семаглутид пен парацетамолды бiр мезгiлде қабылдаған кезде соңғысының дозасын түзету талап етiлмейдi.
Ауыз арқылы қабылданатын гормоналдық контрацептивтiк заттар
Семаглутид Ауыз арқылы қабылданатын гормоналдық контрацептивтiк заттардың тиiмдiлiгiн төмендетедi деп болжанбайды. Бiрiктiрiлген ауызша гормоналдық контрацептивтiк препаратты (0,03 мг этинилэстрадиол/0,15 мг левоноргестрел) және семаглутидтi бiр уақытта қолданғанда соңғысы этинилэстрадиол мен левоноргестрелдiң жалпы экспозициясына клиникалық маңызды әсер етпедi. Этинилэстрадиолдың экспозициясына әсерi тиген жоқ; левоноргестрелдiң тепе-теңдiк күйiндегi экспозициясының 20 %-ға артуы байқалды. C max компоненттердiң ешқайсысы үшiн өзгерген жоқ.
Аторвастатин
Семаглутид аторвастатиннiң бiр реттiк дозасын (40 мг) қолданғаннан кейiн аторвастатиннiң жүйелiк экспозициясын өзгерткен жоқ. Аторвастатиннiң Cmax 38 %-ға төмендедi. Бұл өзгерiс клиникалық тұрғыдан маңызды емес деп саналды.
Дигоксин
Семаглутид дигоксиннiң бiр реттiк дозасын (0,5 мг) қолданғаннан кейiн дигоксиннiң жүйелiк экспозициясын немесе C max өзгерткен жоқ.
Метформин
Семаглутид метформиндi 3,5 күн бойы күнiне 2 рет 500 мг дозада қолданғаннан кейiн метформиннiң жүйелiк экспозициясын немесе Cmax -тi өзгерткен жоқ.
Варфарин
Семаглутид варфариннiң бiр реттiк дозасын (25 мг) қолданғаннан кейiн варфариннiң жүйелiк экспозициясын немесе Cmax R- және S-изомерлерiн өзгерткен жоқ. Варфариннiң фармакодинамикалық әсерлерiнiң клиникалық маңызды өзгерiстерi халықаралық нормаланған арақатынасты (ХНА) анықтамасы негiзiнде де байқалмады.
Үйлесiмсiздiгi
Семавик® препаратын басқа дәрiлiк заттармен, оның iшiнде инфузиялық ерiтiндiлермен араластыруға болмайды. Семавик® препаратына қосылған заттар семаглутидтiң деградациясын тудыруы мүмкiн.
Ерекше нұсқаулар
Семавик® препаратын қолдану ҚД1 бар пациенттерде немесе диабеттiк кетоацидозды емдеу үшiн қарсы көрсетiледi. Семавик® препараты инсулиндi алмастырмайды
АІЖ тарапынан реакциялар
ГТП-1Р агонистерiн қолдану АІЖ тарапынан ЖР-мен байланысты болуы мүмкiн. Мұны бүйрек жеткiлiксiздiгi бар пациенттердi емдеу кезiнде ескеру керек, өйткенi жүрек айнуы, құсу және диарея сусыздануға және бүйрек функциясының нашарлауына әкелуi мүмкiн.
Жiтi панкреатит
ГТП-1Р агонистерiн қолданған кезде жiтi панкреатиттiң даму жағдайлары байқалды. Пациенттер жiтi панкреатиттiң тән симптомдары туралы хабардар болуы тиiс. Панкреатитке күдiк болған кезде Семавик® препаратымен терапия тоқтатылуы тиiс; жiтi панкреатит расталған жағдайда Семавик® препаратымен терапияны қайта бастауға болмайды. Анамнезiнде панкреатитi бар пациенттерде сақтық таныту керек. Жiтi панкреатиттiң басқа белгiлерi мен симптомдары болмаған кезде ұйқы безi ферменттерiнiң белсендiлiгiнiң жоғарылауы жiтi панкреатиттiң дамуының болжамды факторы болып табылмайды.
Гипогликемия
Семавик® препаратын сульфонилнесепнәр туындыларымен немесе инсулинмен бiрге қабылдайтын пациенттерде гипогликемияның даму қаупi жоғары болуы мүмкiн. Семавик® препаратымен емдеудiң басында гипогликемияның даму қаупiн сульфонилнесепнәр немесе инсулин туындысының дозасын азайту арқылы азайтуға болады.
Диабеттiк ретинопатия
Инсулин мен семаглутидпен терапияны алатын диабеттiк ретинопатиясы бар пациенттерде диабеттiк ретинопатияның асқыну қаупiнiң жоғарылауы байқалды («Жанама әсер» бөлiмiн қар.). Инсулин терапиясын алатын диабеттiк ретинопатиясы бар пациенттерде семаглутидтi қолданғанда сақ болу керек. Мұндай пациенттер үнемi бақылауда болуы керек және клиникалық нұсқауларға сәйкес емделуi керек. Гликемиялық бақылаудың тез жақсаруы диабеттiк ретинопатияның уақытша нашарлауымен байланысты болды, алайда бұл ретте басқа себептердi жоққа шығаруға болмайды.
Жүрек жеткiлiксiздiгi
NYНА жiктелiмiне сәйкес IV функциялық класты СЖЖ бар пациенттерде Семавик® препаратын қолдану тәжiрибесi жоқ. Мұндай пациенттерде препаратты қолдануға болмайды.
Қалқанша без аурулары
ГТП-1-нiң басқа аналогы лираглутидтi қолданудың тiркеуден кейiнгi кезеңiнде қалқанша безiнiң медуллярлық қатерлi iсiгi (ҚБМҚ) жағдайлары байқалды. Қолда бар деректер ГТП-1 аналогтарын қолдана отырып, ҚБМҚ пайда болуының себеп-салдарлық байланысын анықтау немесе болдырмау үшiн жеткiлiксiз. Пациентке ҚБМҚ қаупi және қалқанша безiнiң iсiк симптомдары (мойын аймағында түйiннiң пайда болуы, дисфагия, ентiгу, дауыстың өтпейтiн қарлығуы) туралы хабарлау қажет. Қан плазмасындағы кальцитонин концентрациясының айтарлықтай жоғарылауы ҚБМҚ-ны көрсетуi мүмкiн (ҚБМҚ бар пациенттерде қан плазмасындағы кальцитонин концентрациясының мәндерi әдетте >50 нг/л). Егер қан плазмасындағы кальцитонин концентрациясының жоғарылауы анықталса, пациенттi одан әрi тексеру керек. Физикалық тексеру кезiнде немесе қалқанша безiнiң ультрадыбыстық зерттеуiнде анықталған қалқанша безiнiң түйiндерi бар пациенттер де қосымша тексеруден өтуi керек. Семаглутидтi жеке немесе отбасылық анамнезi бар немесе 2 типтi ҚБМҚІ синдромы бар пациенттерде қолдану қарсы көрсетiледi.
Клиникаға дейiнгi қауiпсiздiк деректерi
Фармакологиялық қауiпсiздiктi, қайталама дозалардың уыттылығын және геноуыттылықты зерттеуге негiзделген клиникаға дейiнгi деректер адамдар үшiн ешқандай қауiп анықтамады. Клиникалық маңызды концентрацияларда егеуқұйрықтар мен тышқандардағы канцерогендiлiктiң 2 жылдық зерттеулерiнде семаглутид өлiмге әкелмейтiн қалқанша безi С жасушалары iсiктерiнiң дамуына себеп болды. Егеуқұйрықтарда байқалатын өлiмге әкелмейтiн қалқанша безiнiң С жасушаларының iсiктерi ГТП-1 аналогтарының тобына тән. Адамдарға қатысты бұл тәуекел төмен деп саналады, бiрақ оны толығымен жоюға болмайды.
Ұрықтылық
Семаглутидтiң адамдардағы ұрықтылыққа әсерi белгiсiз. Семаглутид еркек егеуқұйрықтардың ұрықтылығына әсер еткен жоқ. Ұрғашы егеуқұйрықтар арасында эстральдi циклiнiң жоғарылауы және овуляция санының шамалы төмендеуi ұрғашының дене салмағының төмендеуiмен бiрге жүретiн дозаларда байқалды.
Көлiк құралдарын және механизмдердi басқару қабiлетiне әсер етуi
Семавик® препараты көлiк құралдарын басқару қабiлетiне немесе механизмдермен жұмыс iстеуге әсер етпейдi немесе аз әсер етедi. Пациенттерге көлiк құралдарын басқару кезiнде және механизмдермен жұмыс iстеу кезiнде, әсiресе Семавик® препаратын сульфонилнесепнәр туындысымен немесе инсулинмен бiрге қолданғанда, гипогликемияның дамуын болдырмау үшiн сақтық шараларын сақтау керектiгi туралы ескертiлуi тиiс.
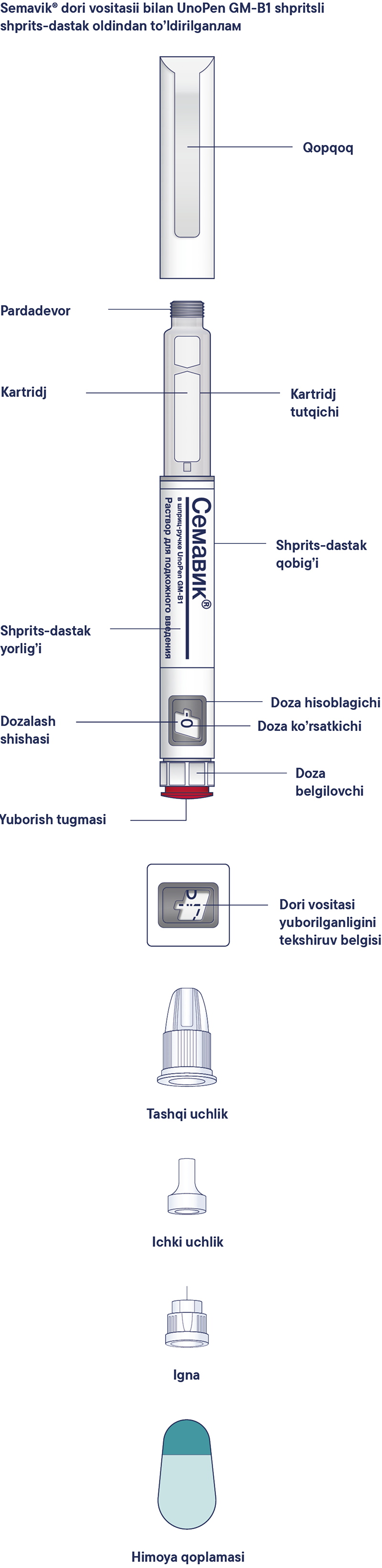
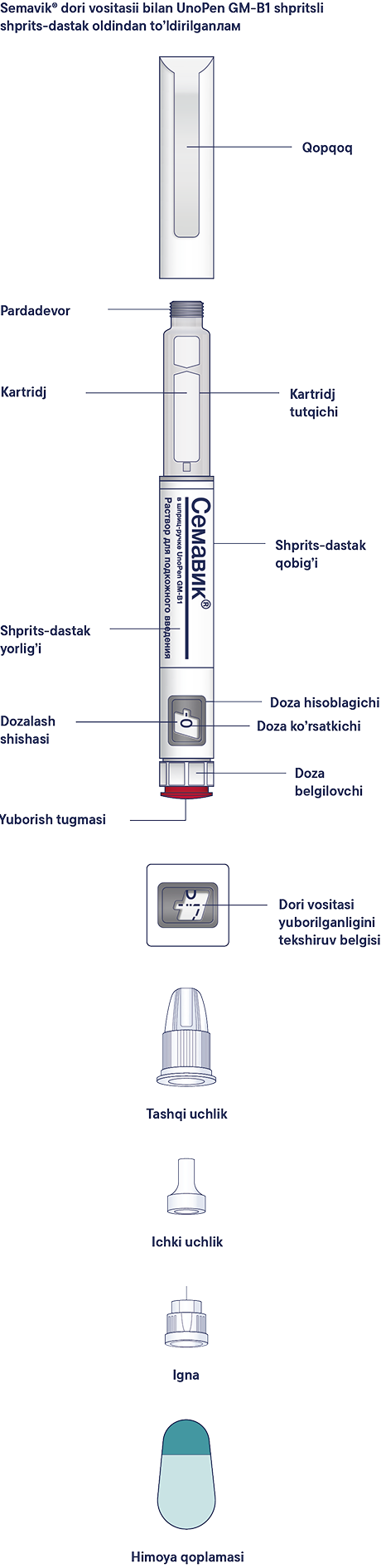
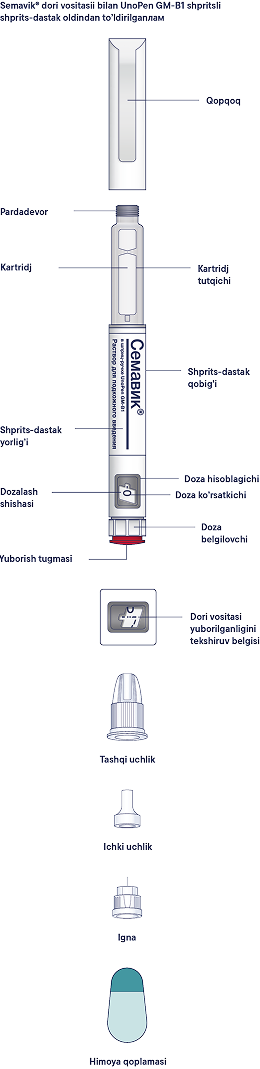
Пайдалану жөнiндегi нұсқаулық
Алдын ала толтырылған Семавик® шприц-қаламы 0,25 мг, 0,5 мг және 1 мг дозаларды енгiзуге мүмкiндiк бередi. Бiр шприц-қаламда 3 мл ерiтiндi бар. Семавик® препаратының қаптамасында бiр реттiк инелер бар. Пациентке әр инъекциядан кейiн инъекциялық иненi жергiлiктi талаптарға сәйкес тастау ұсынылады. Семавик® шприц-қаламы тек жеке пайдалануға арналған. Семавик® препаратын, егер ол мөлдiр түссiз немесе түссiз дерлiк ерiтiндiден өзгеше көрiнсе, қолдануға болмайды. Семавик® препаратын, егер ол мұздатылған болса, қолдануға болмайды. Семавик® препаратын ұзындығы 8 мм-ге дейiнгi инелермен енгiзуге болады. Шприц-қалам бiр реттiк инъекциялық инелермен пайдалануға арналған. Әр инъекциядан кейiн әрқашан иненi алып тастаңыз және Семавик® шприц-қаламын инесi ажыратылған күйде сақтаңыз. Бұл инелердiң бiтелуiн, ластануын, жұқтыруды, ерiтiндiнiң ағып кетуiн және препараттың қате дозасын енгiзудi болдырмауға көмектеседi.
Шығарылу түрi
Терi астына енгiзуге арналған ерiтiндi, 1,34 мг/мл. Резеңке дискiлерi бар алюминийден жасалған аралас қалпақшалармен оралған, резеңке плунжерлерi бар бейтарап шыныдан жасалған түссiз картридждерге препараттың 3 мл-нен. Картридж көп реттiк инъекцияға арналған пластикалық мультидозалы бiр реттiк шприц-қаламға орнатылады. Әрбiр шприц-қаламның корпусына полипропилен үлдiрiнен жасалған жапсырма жабыстырылады. Картоннан жасалған бумаға дәрiлiк препаратты медициналық қолдану жөнiндегi нұсқаулығы және шприц-қаламды пайдалану жөнiндегi нұсқаулығы бар көп реттiк инъекцияға арналған 1 алдын ала толтырылған мультидозалы бiр реттiк шприц-қаламнан және 4 бiр реттiк инеден салынады.
Жарамдылық мерзiмi
2 жыл. Шприц-қалам жапсырмасында және қаптамада көрсетiлген мерзiм өткеннен кейiн қолдануға болмайды.
Сақтау шарттары
2 °C-тан 8 °C-қа дейiнгi температурада сақтаңыз (тоңазытқышта), бiрақ мұздатқыш камераның жанында емес. Жарықтан қорғаңыз. Мұздатпау қажет. Препаратпен бiрге пайдаланылатын немесе қосалқы ретiнде тасымалданатын шприц-қаламды 30 °С жоғары емес температурада немесе 2 °С-тан 8 °С-қа дейiнгi температурада (тоңазытқышта) 6 апта бойы сақтау керек. Мұздатпау қажет. Қолданғаннан кейiн шприц-қаламды жарықтан қорғау үшiн қалпақшамен жабыңыз. Семавик® препаратын артық жылу мен жарықтың әсерiнен қорғау керек. Балалардың қолы жетпейтiн жерде сақтау керек.
Босатылу шарттары
Рецептпен босатылады.
Өндiрушi
ООО «ГЕРОФАРМ», Ресей Федерациясы
UnoPen GM-B1 пен-инъекторы гипогликемиялық зат, глюкагон тәрiздi пептид-1 (ГТП-1) — Семаглутид баламасы бар алдын ала толтырылған бiр реттiк көп реттiк инъекцияларға арналған шприц-қалам (бұдан әрi — «Шприц-қалам») болып табылады. Семавик® (0,25 мг/доза, 0,5 мг/доза, 1,0 мг/доза) — алдын ала толтырылған шприц-қаламда т/а енгiзуге арналған ерiтiндi 0,25 мг, 0,5 мг және 1,0 мг дозаларды енгiзуге мүмкiндiк бередi. Шприц-қалам 0,25 мг дозаны титрлеуге және 0,5 мг және 1,0 мг терапевтiк дозаны сақтауға арналған. Бiр шприц-қаламда 3 мл ерiтiндi бар.
Семавик® препаратын енгiзу кезiнде шприц-қаламды пайдалану нұсқалары:
1-нұсқа - дозаны титрлеу
0,25 мг-нан 4 инъекция
0,5 мг-нан 4 инъекция
1,0 мг-нан 1 инъекция
2-нұсқа - терапевтiк дозаны сақтау
1,0 мг-нан 4 инъекция
Шприц-қалам BD Micro-Fine™ Plus бiр реттiк инъекциялық инелермен пайдалануға арналған. Семавик® препаратының қаптамасына Well Fine 4 mm 32G немесе Dexfine 4 mm 32G немесе Verifine 4 mm 32G инелерiнiң 4 данасы кiредi
Семавик® препаратын ұзындығы 8 мм-ге дейiнгi инелермен енгiзуге болады.
Әр инъекция алдында жаңа иненi қолдану керек. Инъекциядан кейiн шприц-қаламды инесiз сақтау және тасымалдау қажет! Бұл инелердiң бiтелуiне, ластануына, жұқтыруға, ерiтiндiнiң ағып кетуiне және препараттың қате дозасын енгiзуге жол бермейдi. Инелердi ықтимал жұқтырған материалдармен жұмыс iстеу нормалары мен ережелерiн сақтай отырып, жергiлiктi талаптарға сәйкес кәдеге жарату керек. Шприц-қаламды тек бiр адам қолдануы керек. Шприц-қалам үшiншi тұлғаға берiлмеуi тиiс.
Егер шприц-қаламдағы Семавик® препараты түссiз мөлдiр ерiтiндiден өзгеше болып көрiнсе, онда оны қолдануға болмайды.
Қаламдарды төмен (+2 °C-тан төмен) және жоғары (+30 °C-тан жоғары) температуралардың әсерiне ұшыратпаңыз. Шприц-қаламдарды мұздатқыш камераға салмаңыз. Шприц-қаламдарды мұздатуға болмайды!
Пайдаланылған шприц-қаламдар кәдеге жаратуға жатады және оларды қайта пайдалануға (шприц-қаламды қайта толтыруға) болмайды.
Шприц-қаламдарды жоғары/төмен ауа температурасында арнайы термоқаламсауытта/сөмкеде (мысалы, ГЕРОФАРМ термоқаламсауытында) тасымалдау жөн.
Шприц-қалам мен инелердi көпшiлiкке, әсiресе балаларға, қолжетiмсiз жерлерде сақтаңыз.
Шприц-қаламды өз бетiңiзше жөндеуге тырыспаңыз. Бұзылған жағдайда препаратты медициналық қолдану жөнiндегi нұсқаулықта көрсетiлген тұтынушылардың шағымдарын қабылдайтын ұйымға хабарлаңыз.
ГЕРОФАРМ ақпараттық көмек желiсiнiң телефоны: 8 (800) 333-43-76.
Алдын ала толтырылған шприц-қаламға терi астына енгiзуге арналған ерiтiндi (көп реттiк инъекцияға арналған бiр реттiк мультидозалы)
Алдын ала толтырылған Семавик® шприц-қаламын қолданар алдында осы нұсқаулықты мұқият оқып шығыңыз.
Шприц-қаламды дәрiгердiң немесе медбикенiң нұсқауымен қолдануды үйренгеннен кейiн ғана қолданыңыз.
Құрамында Семавик® 0,25 мг/доза, 0,5 мг/доза немесе 1 мг/доза препараты бар екенiне көз жеткiзу үшiн шприц-қаламды тексеруден бастаңыз, содан кейiн шприц-қалам мен иненiң әртүрлi бөлiктерiмен танысу үшiн төмендегi суреттердi қараңыз.
Егер сiз нашар көретiн болсаңыз немесе көру қабiлетiңiзде елеулi проблемалар болса және доза есептегiшiндегi сандарды ажырата алмасаңыз, шприц-қаламды көмексiз қолданбаңыз. Семавик® препаратымен алдын ала толтырылған шприц-қаламды қолдануға үйретiлген көру қабiлетi жақсы адам сiзге көмектесе алады.
Бұл шприц-қалам — алдын ала толтырылған шприц-қалам. Оның құрамында 4 мг семаглутид бар және ол 0,25 мг, 0,5 мг немесе 1 мг дозаларды таңдауға мүмкiндiк бередi. Шприц-қалам ұзындығы 8 мм-ге дейiнгi бiр реттiк инелермен пайдалануға арналған.
Инелер қаптамада бар.
Маңызды ақпарат
Осындай белгiшелермен белгiленген ақпаратқа ерекше назар аударыңыз, бұл шприц-қаламды қауiпсiз пайдалану үшiн өте маңызды.
Әр инъекциядан кейiн әрдайым иненi лақтырып тастаңыз, бұл ыңғайлы инъекцияны қамтамасыз етедi және иненiң бiтелуiне жол бермейдi. Ине бiтелiп қалса, сiз өзiңiзге препаратты енгiзе алмайсыз. Дәрiгер, медбике, фармацевт берген нұсқауларға немесе жергiлiктi талаптарға сәйкес инесi босатылған бос шприц-қаламды тастаңыз. Ешқашан iшкi қалпақшаны инеге қайта кигiзуге тырыспаңыз. Шаншылуыңыз мүмкiн. Әр инъекциядан кейiн әрқашан иненi шприц-қаламнан дереу алып тастаңыз. Бұл инелердiң бiтелуiн, ластануын, инфекциялануды, ерiтiндiнiң ағып кетуiн және препараттың қате дозасын енгiзудi болдырмауға көмектеседi.
Қосымша маңызды ақпарат
Шприц-қаламға күтiм жасау
Шприц-қаламды ақырын ұстаңыз. Ұқыпсыз қолдану немесе қате қолдану препараттың дұрыс емес дозасын енгiзуге әкелуi мүмкiн, нәтижесiнде қан глюкозасының жоғары концентрациясы немесе iш аймағындағы ыңғайсыздық (жүрек айну немесе құсу) болуы мүмкiн.
Бiрiншi инъекция алдында UnoPen GM-B1 алдын ала толтырылған бiр реттiк шприц-қаламдарын пайдалану жөнiндегi нұсқаулықты мұқият оқып шығып, зерттеу керек.
Шприц-қаламды қолдану бойынша емдеушi дәрiгермен (маманмен) кеңесу қажет. Шприц-қаламның дұрыс қолданылуын көрсетудi сұраңыз. Препараттың алғашқы инъекциясы дәрiгердiң немесе медбикенiң бақылауымен жүргiзiлуi тиiс.
Шприц-қаламдағы жапсырманы мұқият оқып шығыңыз және дәрiгер тағайындаған дәрiлiк препарататi қажеттi дозалауда қолданғаныңызға көз жеткiзiңiз, сонымен қатар препараттың жарамдылық мерзiмiн тексерiңiз. Содан кейiн шприц-қаламның сипаттамалары мен құрамдас бөлiктерiмен танысу үшiн төменде көрсетiлген суреттерге қараңыз.
Шприц-қаламды пайдалануды бастамас бұрын оны көрiнетiн механикалық зақымданулар, аққан сұйықтық iздерi (картридждiң саңылаусыздығының бұзылғанын көрсететiн) бар-жоғын тексеру қажет. Егер сiз шприц-қаламның дұрыс жұмыс iстейтiнiне және оның зақымдалмағанына сенiмдi болмасаңыз, шприц-қаламды ешқашан қолданбаңыз. Әр инъекция алдында әрқашан шприц-қаламды тексерiңiз.
Шприц-қаламды пайдалану жөнiндегi нұсқауларды мұқият орындаңыз: қаламның құлауының және басқа сыртқы факторлардың әсерiнiң алдын алыңыз (термиялық әсер, тiкелей күн сәулелерi, механикалық зақымдану және т. б.). Егер зақымдану болса, жаңа шприц-қаламды қолдануды бастау керек.
Көру қабiлетi нашар пациент немесе көру қабiлетiнiң ауыр проблемалары бар және доза есептегiшiндегi сандарды ажырата алмайтын пациент шприц-қаламды препаратты алдын ала толтырылған шприц-қаламмен енгiзу бойынша оқытудан өткен медициналық персоналдың, туыстарының немесе көру қабiлетi жақсы адамның бақылауымен қолдануы керек.
Инемен түйреу және тоғыспалы инфекциялануды болдырмау үшiн науқасқа күтiм жасайтын тұлғалар қолданылған инелердi өте сақтықпен ұстауы керек.
Семавик® препаратымен алдын ала толтырылған UnoPen GM-B1 шприц-қалам